Problema 13.8.5
Il carbonio in natura consiste di due isotopi (atomi che hanno le stesse proprietà chimiche ma masse differenti). La massa dell’isotopo del carbonio più abbondante viene assunta esattamente uguale a 12,00 u. Quando il carbonio viene messo in uno spettrografo di massa, sulla lastra fotografica si formano due linee, in corrispondenza a questi isotopi.
Supponiamo che le linee indichino che l’isotopo più abbondante si è mosso su una circonferenza di 15,0 cm di raggio, e che l’isotopo più raro si è mosso su una circonferenza di 15,6 cm di raggio.
Quanto vale la massa dell’isotopo più raro?
(Spettrografo di massa A – fig.13.22)
Vedi Problema 13.8.4
mC1=12 u
RC1=15,0 cm RCx=15,6 cm
mv2/R=evB 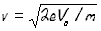
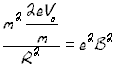
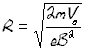
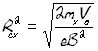
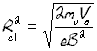
mx/mC1=Rcx2/Rc12 mx/mC1=(15,6/15,0)2
mx=(15,6/15,0)2.12=12,98 ≈ 13u
1u=1,67.10-27Kg (Cap.15.6)