Problema 12.5.8
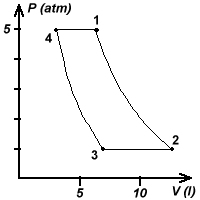
Una massa di gas He viene sottoposta al seguente ciclo reversibile:
1) espansione adiabatica dallo stato 1 allo stato 2 (P1=5,0atm, V1=5,0l, T1=327°C, T2=300K)
2) a pressione costante fino a raggiungere una temperatura T3=T2/2
3) compressione adiabatica fino a ritornare alle pressione iniziale
4) espansione isobara fino a ritornare nelle condizioni iniziali
Calcolare:
a) il rendimento del ciclo;
b) le variazioni di energia interna nelle singole trasformazioni;
c) il lavoro compiuto dal ciclo (in joule);
d) le variazioni di entropia nelle singole trasformazioni.
|
Per rispondere alle domande conviene prima costruirsi un quadro delle coordinate termodinamiche e delle trasformazioni effettuate (grafico). Alla fine la soluzione risulterà notevolmente agevolata.
1) Adiabatica: T1V1γ-1=T2V2γ-1, γ =3/5 (gas monoatomico):
 a) Vedi Cap.12.5 b): η = L/Qf. b) Si tratta di un gas perfetto, quindi per ogni trasformazione ΔU=nCvΔT (Cap.12.4 a)). c) Calcoliamo ora la variazione di entropia nelle singole trasformazioni (Cap.12.5 d)): |