Una quantità m=13g di O2 inizialmente alla pressione p1=1,0atm e alla temperatura t1=27 °C viene riscaldato fino alla temperatura T2 mediante un processo isocoro, facendogli assorbire la quantità di calore Q1,2=990cal.
In seguito lo si lascia espandere adiabaticamente in modo che la pressione p3 sia uguale a quella iniziale p1. Con una successiva compressione isobara viene riportato alle condizioni iniziali. Calcolare le coordinate termodinamiche degli stati 1, 2, 3 e il rendimento η del ciclo; i lavori L1,2, L2,3, L3,1 delle singole trasformazioni ed Lc del ciclo; le variazioni di energia interna ΔU1,2, ΔU2,3, ΔU3,1 in ciascuna trasformazione.
(Lavoro in joule ed energia interna in calorie)
|
Guarda la soluzione
|
Vedi Problema 12.5.1 e si supponga il ciclo reversibile.
a) Calcoliamo le coordinate termodinamiche
n=m/M=13/32=0,41moli
|
|
p (atm) |
V (l) |
T (K) |
Stato 1 |
V1=nRT1/p1=m/M RT1/p1
V1=13.0,082.300/32=10l |
1,0 |
10 |
300 |
Stato 2 |
1-2) Q12=nCv(T2-T1)
T2=Q12/nCv+T1
T2=990/0,41.3,5.1,98+300=495+300=795≈800K
p1/p2=T1/T2 (isocora)
p2=800/300=2,67atm |
2,67 |
10 |
800 |
Stato 3 |
2-3) adiabatica p2V2γ=p3V3γ
V3γ=p2/p3.V2γ=p2V2γ
logV3=1/γlogp2+logV2
logV3=0,426/1,4+1=0,305+1=1,305
V3=20l
3-1) isobara V1/V3=T1/T3
T3=T1.V3/V1=300.20/10=600K |
1,0 |
20 |
600 |
Vedi figura.
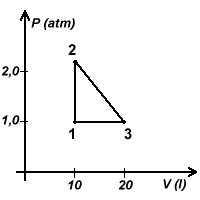
b) η =L/Q12=(Q12-Q31)/Q12 (Cap.12.5 d))
Q31=nCp(T1-T3)
Cp=7R/2 Cv = 5R/2 (gas biatomici)
Q31=-0,40.3,5.1,98 .300=-840cal
η =(990840)/990=0,15=15%
c) L12=0 (isocora)
L23=-ΔU=-nCv(T3-T2)
L23=0,40.3,5.1,98.200=396cal=1660J (adiabatica)
L31=p3(V1-V3)
L31=1,0(-10)=-10l.atm=1010J (isobara)
Lc=Q12-Q31=150cal=630J
Δ U=Q-L (nel ciclo ΔU=0)
Lc=L23+L31=1660-1010=650J (somma di lavori nelle varie trasformazioni del ciclo)
La differenza nei due risultati dipende dalle approssimazioni.
d) ΔU12=Q12=990cal (isocora: L12=0)
ΔU23=-L23=-400cal (adiabatica: Q23=0)
ΔU31=nCv(T1-T3)=0,41.2,5.1,98(-300)=-600cal (isoterma)
oppure
ΔU(del ciclo)=0
ΔU31=400-990=-590cal
|
|
