n=0,46 moli di He, inizialmente alla temperatura t1=127°C ed alla pressione p1=1,0atm, vengono compresse adiabaticamente fino alla pressione p2=3,0atm.
Il gas viene poi riscaldato a volume costante, fornendo dall’esterno la quantità di calore Q2,3=830cal. Da questo stato viene fatto espandere adiabaticamente fino a ritornare alla pressione p1 e quindi, lungo una trasformazione isobarica, ritorna al suo stato iniziale.
Calcolare:
a) Le coordinate termodinamiche nei singoli stati 1, 2, 3, 4.
b) Il rendimento del ciclo.
c) Il lavoro ottenuto dal ciclo (in joule).
d) La variazione di energia interna nelle singole trasformazioni.
|
Guarda la soluzione
|
a) n=0,46moli
t1=127°C=400K
p1=1,0atm
|
|
p (atm) |
V (l) |
T (K) |
Stato 1 |
Applicando l’eq. caratteristica dei gas perfetti pV=nRT:
V1=0,5.0,082.400/1,0=15,1l |
1,0 |
15,1 |
400 |
Stato 2 |
Trasf. adiabatica p1V1γ=p2V2γ:
γ =5/3 (gas monoatomico)
V2=8,0l
T2=p2V2/nR
T2=635K |
3,0 |
8,0 |
635 |
Stato 3 |
Trasf. isocora Q2,3=nCvΔT (Cap.12.3):
Cv=3R/2 (gas monoatomico)
T3=Q/nCv+T2
R=1,98cal/moleK
T3=1236K
p3/p2=T3/T2
p3=6,0atm |
6,0 |
8,0 |
1236 |
Stato 4 |
Trasf. adiabatica:
V4=23,2l
T4=p4V4/nR
T4=616K
oppure
Trasf. isobara 4-1:
V4/V1=T4/T1
T4 =620K |
1,0 |
23,2 |
620
|
Supponendo le trasformazioni reversibili, vedi figura.
|
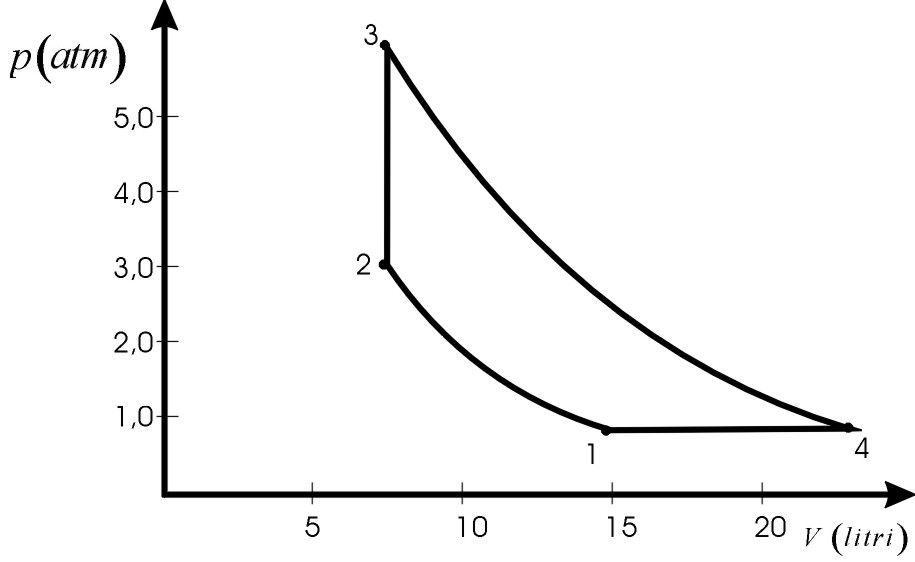
b) η=(Q2,3-Q4,1)/Q2,3 (Cap.12.5 b))
Q4,1=nCp(T1-T4)
Cp=5R/2
Q4,1=506cal
η =38%
c) ΔU=Q-L
Δ U=0, L=Q (ciclo)
L=Q2,3-Q4,1
L=(830-506)4,18=1354J
d) Δ U=nCv ΔT (gas perfetto, vale in tutte le trasformazioni)
ΔU1,2=nCv(T2-T1)
ΔU1,2= 325cal (ΔU1,2=-L1,2 adiabatica)
ΔU2,3=Q2,3=830cal (L2,3=0 isocora)
ΔU3,4= nCv(T4-T3)
ΔU3,4=-850cal (ΔU3,4=-L3,4 adiabatica)
ΔU4,1=nCv(T1-T4)
ΔU4,1=-305cal
ΔU1,2+ ΔU2,3+ΔU3,4+ ΔU4,1=0
|
|
