Un cilindro contiene elio alla pressione di 2,0 atm. Il volume è di 3,0 litri e la temperatura di 300°K.
L’elio è sottoposto ai seguenti processi reversibili:
1) riscaldato a pressione costante fino a 500K;
2) raffreddato a volume costante fino a 250K;
3) raffreddato a pressione costante fino a 150K;
4) riscaldato a volume costante fino a 300K.
a) Rappresentare i quattro processi in un diagramma p,V.
b) Calcolare le variazioni di energia interna nelle singole trasformazioni.
|
Guarda la soluzione
|
a) Applico l’eq.caratteristica dei gas perfetti (Cap.12.1) pV=nRT per calcolare il numero delle moli n.
1) |
n=pV/RT
n=2,0.3,0/0,082.300=0,2 moli |
p1=2,0atm
V1=3,0l
T=300K |
2) |
V2/V1=T2/T1
V2=3,0.500/300=5,0 litri |
p2=2,0atm
V2=5,0l
T=500K |
3) |
p3/p2=T3/T2
p3=2,0/2=1,0atm |
p3=1,0atm
V3=5,0l
T=250K |
4) |
V4/V3=T4/T3
V4=5,0.150/250=3,0l |
p4=1,0atm
V4=3,0l
T4=150K |
Poi torna nelle condizioni iniziali (ciclo).
In figura sono rappresentati i quattro processi.
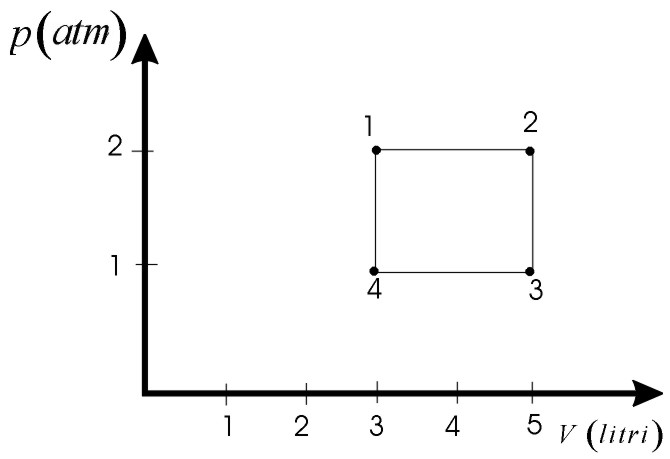
b) Vedi Problema 12.4.1.
ΔU=nCVΔ T
nCV=0,24.(3/2).8,31=3,0J/K (il gas è monoatomico)
ΔU1,2=3,0.200=600J
ΔU2,3=3,0.(-250)=-750J
ΔU3,4=3,0.(-100)=-300J
ΔU4,5=3,0.150=450J
Si può verificare che 600-750-300+450=0 (ΔU in un ciclo è zero!).
In questo caso risulta anche facile calcolare il lavoro ottenuto dal ciclo; si tratta di calcolare l’area nel grafico (Cap.12.2 d)).
L=2,0atm.2,0l=4,0litri.atm=404J
1litri.atm=10-3m3.1,013N/m2=101J
Conosciamo anche la quantità di calore assorbita dal gas nel ciclo.
Q=L=404J=404.4,18=1689cal
|
|
