Problema 12.4.1
Un gas perfetto monoatomico, inizialmente alla temperatura T1=800K, pressione p1=1,0atm, occupa un volume V1=40l.
Il gas è sottoposto al ciclo costituito dalle seguenti trasformazioni:
1) Compressione isobarica dalla temperatura T1 a T2=400K;
2) Compressione isoterma fino a raggiungere una pressione p3=2,0atm;
3) Espansione a pressione costante durante la quale si ritorna alla temperatura iniziale T1.
4) Espanzione isoterma fino a ritornare nelle condizioni iniziali
Calcolare:
a) le coordinate termodinamiche nei punti 1,2,3,4;
b) la variazione di energia interna nelle singole trasformazioni.
|
a) Applichiamo l’equazione di stato dei gas perfetti (Cap.12.1) pV=nRT e ricaviamo il numero di moli n del gas:
Le coordinate termodinamiche sono riportate anche in figura, nell’ipotesi che le trasformazioni siano reversibili. 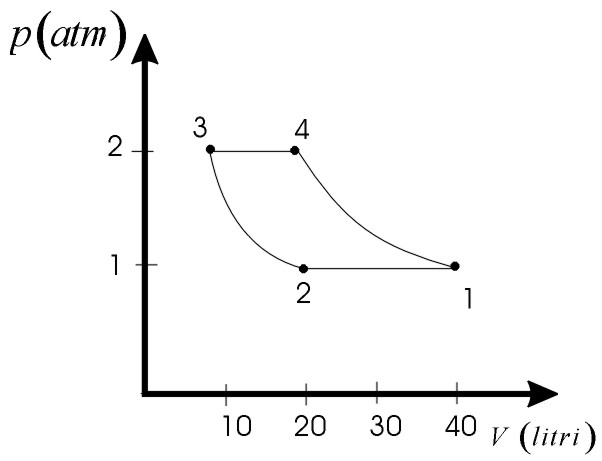 b) Vedi Cap.12.4 a). |