Problema 12.1.9
Due cilindri uguali di sezione S=30cm2, verticali, collegati tra di loro da un tubo di dimensioni trascurabili, fornito di un rubinetto R, sono chiusi da due pistoni liberi, scorrevoli senza attrito, a perfetta tenuta, e di peso P=20N (fig.12.1).
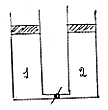
Quando il rubinetto è chiuso, nel cilindro 1 è contenuto un volume V1=5,0l di O2 alla temperatura T1=323K e nel cilindro 2 un volume V2=7,0 litri di He alla temperatura T2=300K.
a) Calcolare le masse m1 e m2 di gas contenute nei due cilindri.
b) Se si apre il rubinetto R e si porta la temperatura del miscuglio a T0=273°C, qual è in volume totale V dei due gas?
La pressione esterna è p0=10N/cm2.
Applichiamo l’eq. caratteristica dei gas perfetti (Cap.12.1) pV=nRT
p1V1=n1RT1
p2V2=n2RT2
p1=p2=p0+P/S
p1=p2=10+20/30=32/3=10,7N/cm2
n1=p1V1/RT1
n1=0,2 moli
m1=n1M1 M1=32g/mole
m1=6,4g
n2=p2V2/RT2
n2=0,3 moli
m2=n2M2
M2=4g/mole m2=1,2g
In una miscela di due o più gas (che non reagiscono tra loro) ciascun componente esercita una pressione parziale uguale a quella che eserciterebbe se occupasse da solo tutto il volume a disposizione (legge di Dalton).
Vale ancora l’equazione di stato, purchè si assuma per n il valore n=n1+n2.
p=p1=p2
V=(n1+n2)RT/p
V=10,5l