Una massa di 16g di O2, che inizialmente occupa il volume V1=2,0l alla pressione p1=2,0 atm, viene compresso a volume costante, fino a raggiungere una temperatura T2=300°K. Viene poi lasciato espandere a pressione costante fino a raggiungere nuovamente una temperatura T3=T1.
Calcolare i valori p,V,T nei tre stati 1, 2, 3.
|
Guarda la soluzione
|
Vedi Problema 12.1.2.
Per calcolare le coordinate termodinamiche del primo stato applico l’equazione caratteristica dei gas perfetti (Cap.12.1) pV=nRT dove n=m/M (M=32g/mole per l’ossigeno).
n=16/32=0,5moli
R=0,082latm/moliK
|
|
P
(atm)
|
V
(l)
|
T
(K)
|
I Stato |
p1=2,0atm V1=2,0l T1=p1V1/nR
T1=2,0.2,0/(0,5.0,082)=97,6K |
2,0 |
2,0 |
97,6 |
II Stato |
V2=V1 T2=300K p2=p1 T2/T1
p2=2,0.300/97,6=6,14atm |
6,14 |
2,0 |
300 |
III Stato |
p3=p2 T3=T1
V3 si può calcolare sia con la I legge di Gay-Lussac (isobara):
V3=V2 T3 /T2
V3=2,0.97,6/300=0,65l
sia con la legge di Boyle, considerando che lo stato 1 e lo stato 3 si trovano sulla stessa isoterma:
p1V1=p3V3 V3=p1V1/p3
V3=2,0.2,0/6,14=0,65l |
6,14 |
0,65 |
97,6 |
Nel risolvere i problemi di termodinamica conviene avere sempre un quadro aggiornato delle coordinate termodinamiche di ogni stato. Fin dall’inizio sistemare i valori noti, poi aggiungere gli altri man mano che si calcolano.
Nello stesso modo conviene costruire il grafico (p,V), dove vengono riportati gli stati e le trasformazioni.
Per questo caso vedi figura.
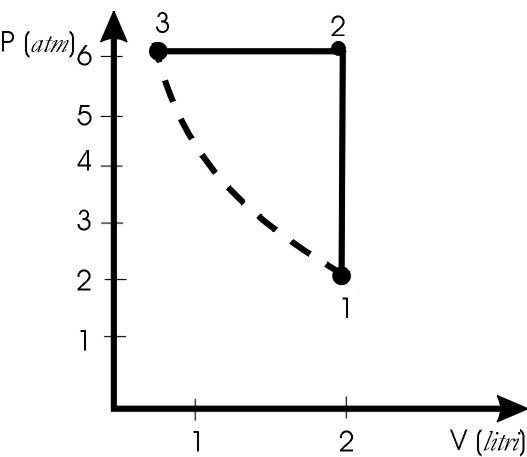
L’isoterma pV=cost. è rappresentata da un ramo di iperbole passante per 1 e 3.
|
|
