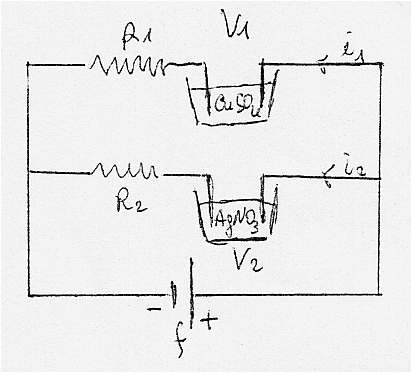
Problema 11.15.1
Due voltametri V1 e V2 rispettivamente contenenti solfato di rame (CuSO4) e nitrato di argento (AgNO3) sono posti in parallelo su una f.e.m.(vedi fig.11.46). Dopo un certo tempo ai catodi dei due voltametri si sono depositati rispettivamente m1=4,94g di rame e m2=11,14g di argento.
Calcolare il rapporto fra le resistenze delle celle.
(per Cu A=63,57 Z=2; per Ag A=107,9 e Z=1)
Utilizzando le leggi di Faraday m=AQ/ZNe
si ha:
m1= ACui1t/(ZCuNe) m2= AAgi2t/(ZAgNe)
Considerando trascurabile la resistenza interna del generatore:
i1= f/R1 e i2= f/R2 , essendo i voltametri in parallelo
m1/m2=((ACui1t)/(ZCuNe))/((AAgi2t)/(ZAgNe))
m1/m2=((ACuft)/(ZCuR1Ne)) / ((AAgft)/(ZAgR2Ne))
m1/m2=(ACuZAgR2)/(ZCuAAgR1)
essendo lo stesso il tempo t.
Si può così ricavare il rapporto fra le resistenze delle due celle:
R2/R1=(m1ZCuAAg)/(m2ZAgACu)
R2/R1=(4,94/11,14) . (2/1) . (107,9/63,57)=1,5